La Biomasse Microbienne Moléculaire (BMM) : Différence entre versions
(→Comment interpréter la Biomasse microbienne moléculaire ?) |
(→Comment interpréter la Biomasse microbienne moléculaire ?) |
||
| Ligne 41 : | Ligne 41 : | ||
| − | [[Fichier:UsageBMM.jpg | + | [[Fichier:UsageBMM.jpg]] |
''Effet des grands modes d’usage sur la BMM'' | ''Effet des grands modes d’usage sur la BMM'' | ||
Version du 18 décembre 2023 à 10:30
La biomasse microbienne moléculaire permet de mesurer l’abondance des microorganismes dans le sol, à partir de l’ADN total microbien extrait.
Sommaire
Que sont les microorganismes ?
Les microorganismes (organismes invisibles à l’œil nu) sont les plus abondants et les plus diversifiés au sein de la biodiversité des sols. Principalement représentés par les bactéries et les champignons, ils jouent un rôle majeur dans le fonctionnement des sols agricoles en participant à la fourniture en éléments nutritifs, à la structuration des sols, à la dégradation des polluants et à la régulation biologique (contrôle des bioagresseurs).
La méthode de prélèvement
La stratégie d’échantillonnage est identique à celle d’une analyse de terre classique (échantillon composite de 15 prélèvements à la tarière), sur une profondeur de 0 à 20 cm. Il faut éviter de prélever à moins de 2 mois (3 mois dans l’idéal) après un apport de carbone au sol (enfouissement des résidus de récolte, destruction des couverts, apport de fertilisants organiques, etc.) ou le dernier chaulage. Il faut également éviter les périodes de stress hydrique (sécheresse, excès d’eau) et thermique (gel, fortes chaleurs). Les périodes recommandées sont le printemps et l’automne. Le prélèvement post-récolte est à proscrire. L’envoi de l’échantillon conditionné dans un sachet plastique doit être rapide (stockage maximum pendant 7 jours en froid positif, pas de congélation).
La méthode d’analyse
L’ADN total est extrait selon la norme NF EN ISO 11063 (2020), adaptée de Terrat et al, 2015 (https://hal.archives-ouvertes.fr/hal-01215318). A réception au laboratoire, l’échantillon est tamisé frais à 2 mm, puis séché à l’air. L’ADN des microorganismes est extrait à partir d’1 g de terre séchée et quantifié par électrophorèse sur gel d’agarose. La biomasse microbienne moléculaire est alors estimée à partir de cette quantité d’ADN. Elle est exprimée en µg d’ADN/g de sol.
 Lysat de sol avant l’extraction de l’ADN
Lysat de sol avant l’extraction de l’ADN
 Quantification de l’ADN sur gel d’agarose par électrophorèse
Quantification de l’ADN sur gel d’agarose par électrophorèse
Les données de référence
La biomasse microbienne moléculaire a été mesurée sur les 2 200 échantillons du Réseau de Mesure de la Qualité des Sols (RMQS), ce qui a permis d’établir une cartographie nationale ainsi qu’un premier référentiel d’interprétation.
Cette carte montre une distribution spatiale hétérogène de l’abondance des microorganismes. En effet, des régions pauvres en biomasse microbienne telles que les landes se distinguent des régions riches, comme le Sud-Est (Gis Sol, 2011). La gamme de variation des sols français va de 1 à plus de 600 µg d’ADN par gramme de sol (Horrigue et al., 2016).
Comment interpréter la Biomasse microbienne moléculaire ?
- 1) Selon le mode d’occupation
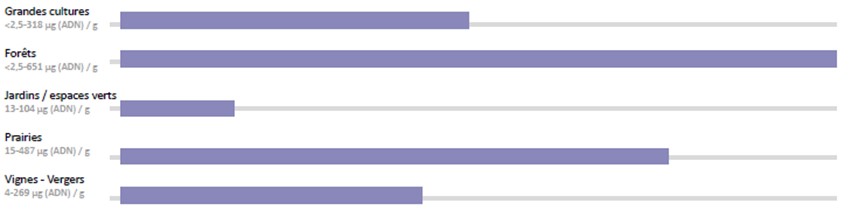
Les données du RMQS (Réseau de mesure de la qualité des sols) permettent de distinguer les grands types d’occupation des sols. Les sols de vigne présentent une faible biomasse microbienne, tout comme les sols de grandes cultures en comparaison des sols sous couvert forestier ou sous prairie (Gis Sol, 2011).
Effet des grands modes d’usage sur la BMM
 Gamme de valeurs de la BMM par usage
Gamme de valeurs de la BMM par usage
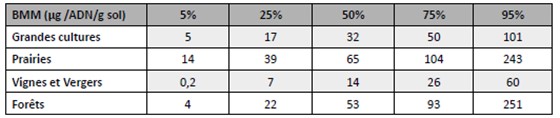
Comment interpréter le tableau ci-dessus ?
Par exemple, 25% des parcelles en Grandes Cultures possèdent une BMM inférieure à 17µg d’ADN par g de sol. Ainsi, si la valeur mesurée sur une parcelle est inférieure à ce seuil, elle peut être considérée comme faible.
- 2) Selon le contexte pédoclimatique
En plus de cette occupation des sols et de la localisation de la parcelle, la valeur de la biomasse microbienne est liée à la texture des sols, leur teneur en carbone organique et leur pH (Dequiedt et al., 2011). En effet, les sols à texture fine (argileuse ou limoneuse) et à pH alcalin (pH>7) avec des teneurs importantes en carbone organique sont plus favorables à la vie microbienne que les sols sableux acides (Gis Sol, 2011).
TABLEAUEFFET.jpg
Ces paramètres physico-chimiques explicatifs permettent d’estimer une valeur de référence de la biomasse microbienne pour chaque parcelle analysée. La comparaison de cette valeur de référence avec la valeur mesurée permet d’émettre un diagnostic de l’impact des pratiques culturales sur l’abondance microbienne (Balloy et al., 2017).
interpretationBMM.jpg
Les effets des pratiques culturales
D’après la littérature, l’abondance des microorganismes est favorisée par l’apport de matières organiques, la diversification des cultures, la présence d’un couvert végétal (prairie, semis sous couvert, etc.), la diminution des produits phytosanitaires de synthèse et la réduction du travail du sol.
Pourquoi mesurer la Biomasse microbienne moléculaire ?
Les microorganismes interviennent dans des fonctions essentielles à la fertilité des sols : - Dynamique des nutriments et du carbone : décomposition des matières organiques, minéralisation N, P, S ; - Agrégation et stabilisation de la structure du sol : sécrétion de mucilages et développement des hyphes ; - Dégradation des polluants organiques (pesticides, hydrocarbures, ...) et transformation des éléments métalliques ; - Contrôle biologique des bioagresseurs.
La biomasse microbienne moléculaire est une mesure directe de la vie du sol. Ce n’est pas une mesure d’activité, mais elle renseigne sur la taille du moteur microbien et son potentiel de fonctionnement (minéralisation des éléments nutritifs et structuration du sol). C’est un indicateur précoce de la réponse des microorganismes du sol à un changement de pratique culturale. Elle permet de renseigner sur la qualité des habitats microbiens et sur la disponibilité des ressources nutritives du sol.
Références bibliographiques : - Balloy B., Bispo A. Bouthier A., Chenu C., Cluzeau D., Degan F., Metzger L., Tour d’horizon des indicateurs relatifs à l’état organique et biologique des sols, version du 27 octobre 2017, 61 p. - Dequiedt, S., Saby, N. P. A., Lelièvre, M., Jolivet, C., Thioulouse, J., Toutain, B., Arrouays D., Bispo A., Lemanceau P., Ranjard, L. (2011). Biogeographical patterns of soil molecular microbial biomass as influenced by soil characteristics and management. Global Ecology and Biogeography, 20(4), 641–652. https://doi.org/10.1111/j.1466-8238.2010.00628.x - Gis Sol. 2011. L’état des sols de France. Groupement d’intérêt scientifique sur les sols, 188 p. - Horrigue, W., Dequiedt, S., Prévost-bouré, N. C., Jolivet, C., Saby, N. P. A., Arrouays, D., Bispo A., Maron P.A., Ranjard, L. (2016). Predictive model of soil molecular microbial biomass. Ecological Indicators, 64, 203–211. https://doi.org/10.1016/j.ecolind.2015.12.004 - NF EN ISO 11063:2020 Qualité du sol - Extraction directe de l’ADN du sol - Karimi B., Chemidlin Prévost-Bouré N., Dequiedt S., Terrat S., Ranjard L., 2018 – Atlas français des bactéries du sol. Biotope, Mèze, Muséum national d’Histoire naturelle, Paris, 192 p. - Terrat S., Plassart P., Bourgeois E., Ferreira S., Dequiedt S., et al.. Meta-barcoded evaluation of the ISO standard 11063 DNA extraction procedure to characterize soil bacterial and fungal community diversity and composition. Microbial Biotechnology, 2015, 8 (1), pp.131-142. ff10.1111/1751-7915.12162ff. ffhal-01215318f