La ratio Champignons sur Bactéries (F/B)
Le ratio Champignons/Bactéries est le rapport des abondances de champignons et de bactéries dans le sol (quantités d’ADNr 18S et 16S mesurées par qPCR).
Sommaire
Que sont les microorganismes ?
Les microorganismes (organismes invisibles à l’œil nu) sont les plus abondants et les plus diversifiés au sein de la biodiversité des sols. Principalement représentés par les bactéries et les champignons, ils jouent un rôle majeur dans le fonctionnement des sols agricoles en participant à la fourniture en éléments nutritifs, à la structuration des sols, à la dégradation des polluants et à la régulation biologique (contrôle des bioagresseurs).
La méthode de prélèvement
La stratégie d’échantillonnage est identique à celle d’une analyse de terre classique (échantillon composite de 15 prélèvements à la tarière), sur une profondeur de 0 à 20 cm. Il faut éviter de prélever à moins de 2 mois (3 mois dans l’idéal) après un apport de carbone au sol (enfouissement des résidus de récolte, destruction des couverts, apport de fertilisants organiques, etc.) ou le dernier chaulage. Il faut également éviter les périodes de stress hydrique (sécheresse, excès d’eau) et thermique (gel, fortes chaleurs). Les périodes recommandées sont le printemps et l’automne. Le prélèvement post-récolte est à proscrire. L’envoi de l’échantillon conditionné dans un sachet plastique doit être rapide (stockage maximum pendant 7 jours en froid positif, pas de congélation).
La méthode d’analyse
L’ADN total est extrait selon la norme NF EN ISO 11063 (2020), adaptée de Terrat et al, 2015 (https://hal.archives-ouvertes.fr/hal-01215318). A réception au laboratoire, l’échantillon est tamisé frais à 2 mm, puis séché à l’air. L’ADN est ensuite purifié afin d’éliminer les éventuels éléments polluants. Une séquence d’ADN spécifique est alors amplifiée par qPCR. Cette application de la PCR permet de déterminer la quantité initiale de l’ADN cible (ADNr 16S pour les bactéries et ADNr 18S pour les champignons), à partir de la quantité d’ADN produite lors de l’amplification par PCR. L’abondance des bactéries et des champignons est exprimée en Nombre de copies.
NB : le résultat ne peut pas être converti en “Nombre de bactéries/champignons par gramme de sol” puisque les gènes utilisés peuvent être présents en plusieurs copies dans un même génome. Le nombre de copies varie en fonction de la taille du génome et de la vitesse de croissance bactérienne ou fongique.
Préparation des échantillons pour les qPCR
Les données de référence
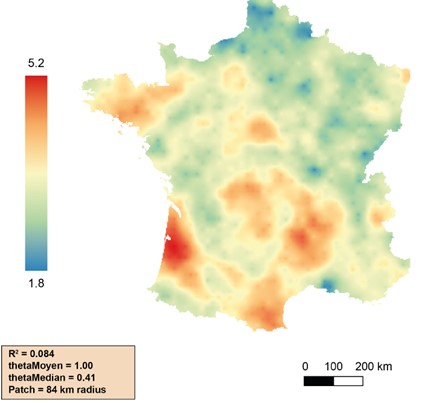
Le ratio F/B a été mesuré sur les 2 200 échantillons du Réseau de Mesure de la Qualité des Sols (RMQS), ce qui a permis d’établir une cartographie nationale ainsi qu’un premier référentiel d’interprétation.
Cette carte montre une distribution spatiale hétérogène du ratio F/B. En effet, quatre régions présentent des valeurs plus élevées : les Landes, la côte méditerranéenne ouest, le Massif central et la Bretagne. Au contraire, le Nord et le Nord-Est de la France présentent des ratios plus faibles. La gamme de variation des sols français va de 0,24 à 12,15 %, avec la majorité des valeurs comprises entre 1 et 5 % (Djemiel et al., 2023)
Comment interpréter la Biomasse microbienne moléculaire ?
- 1) Selon le mode d’occupation
Les données du RMQS (Réseau de mesure de la qualité des sols) permettent de distinguer les grands types d’occupation des sols. Les ratio F/B les plus faibles ont été observés dans les sols de prairies et les plus élevés dans les sols forestiers (Djemiel et al., 2023).
Comment interpréter le tableau ci-dessus ? Par exemple, 25% des parcelles en Grandes Cultures possèdent un ratio F/B inférieure à 1,7 %. Ainsi, si la valeur mesurée sur une parcelle est inférieure à ce seuil, elle peut être considérée comme faible.
- 2) Selon le contexte pédoclimatique
En ce qui concerne les caractéristiques physico-chimiques des sols, le ratio F/B est influencé négativement par le pH, la teneur en carbone organique et la teneur en limons, et positivement par le rapport C/N et la teneur en éléments grossiers (Djemiel et al., 2023).
Ces paramètres physico-chimiques explicatifs permettent d’estimer quatre valeurs de référence pour chaque parcelle analysée, afin de définir les zones en vert, jaune et rouge. La comparaison de ces valeurs de référence avec la valeur mesurée permet d’émettre un diagnostic de l’impact des pratiques culturales sur le ratio F/B.
Les effets des pratiques culturales
Dans la littérature, le ratio F/B est utilisé comme un indicateur global de durabilité et d’auto-régulation de l’écosystème sol (Bardgett and McAlister, 1999). Il est capable de refléter des perturbations du sol du fait de certains usages du sol ou de pratiques culturales (Bailey et al., 2002). Un déséquilibre de ce ratio reflète un état non optimal de fonctionnement biologique du sol. Les rotations de cultures diversifiées, les cultures intermédiaires, la fertilisation organique et la réduction du travail du sol sont les pratiques favorables à cet équilibre (Sunnemann et al., 2021 ; Morugan-Coronado et al., 2022)
Pourquoi mesurer la Biomasse microbienne moléculaire ?
Les microorganismes interviennent dans des fonctions essentielles à la fertilité des sols : - Dynamique des nutriments et du carbone : décomposition des matières organiques, minéralisation N, P, S ; - Agrégation et stabilisation de la structure du sol : sécrétion de mucilages et développement des hyphes ; - Dégradation des polluants organiques (pesticides, hydrocarbures, ...) et transformation des éléments métalliques ; - Contrôle biologique des bioagresseurs.
Les bactéries et champignons ont des implications différentes dans les processus et fonctions du sol, le ratio F/B peut donc en soi être informatif d’orientations fonctionnelles. Une dominance des bactéries oriente vers une voie préférentielle de minéralisation rapide de la matière organique, alors qu’une dominance des champignons oriente vers une voie préférentielle de minéralisation longue avec comme effets une meilleure stabilisation du carbone et une meilleure stabilité des agrégats du sol (Six et al., 2006 ; Strickland and Rousk, 2010 ; Malik et al., 2016)
Références bibliographiques :
- Bardgett, R.D., McAlister, E., 1999. The measurement of soil fungal:Bacterial biomass ratios as an indicator of ecosystem self-regulation in temperate meadow grass¬lands. Biol. Fertil. Soils 29, 282–290. - Bailey, Vanessa L., Jeffrey L. Smith, and H. Bolton Jr. «Fungal-to-bacterial ratios in soils investigated for enhanced C sequestration.» Soil Biology and Biochemistry 34.7 (2002): 997-1007. - Djemiel C., Dequiedt S., Bailly A., Tripied J., Lelièvre M., Horrigue W., Jolivet C., Bispo A., Saby N., Valé M., Maron P-A., Ranjard L., Terrat S., Biogeographical patterns of the soil fungal:bacterial ratio across France, 2023, 20p. - Malik, Ashish A., et al. «Soil fungal: bacterial ratios are linked to altered carbon cycling.» Frontiers in Microbiology 7 (2016): 1247. - Morugán-Coronado, Alicia, et al. «The impact of crop diversification, tillage and fertilization type on soil total microbial, fungal and bacterial abundance: A worldwide meta-analysis of agricultural sites.» Agriculture, Ecosystems & Environment 329 (2022): 107867. - NF EN ISO 11063:2020 Qualité du sol - Extraction directe de l’ADN du sol - Six, J., Frey, S. D., Thiet, R. K., and Batten, K. M. (2006). Bacterial and fungal contributions to carbon sequestration in agroecosystems. Soil Sci. Soc. Am. J. 70, 555–569. doi: 10.2136/sssaj2004.0347 - Strickland, M. S., and Rousk, J. (2010). Considering fungal:bacterial dominance in soils – Methods, controls, and ecosystem implications. Soil Biol. Biochem. 42, 1385–1395. doi: 10.1016/j.soilbio.2010.05.007 - Sünnemann, M., Alt, C., Kostin, J. E., Lochner, A., Reitz, T., Siebert, J., Schädler, M., & Eisenhauer, N. (2021). Low-intensity land-use enhances soil microbial activity, bio¬mass and fungal-to-bacterial ratio in current and future climates. Journal of Applied Ecology, 58, 2614–2625. https://doi.org/10.1111/1365-2664.14004