Aluminium échangeable
L’aluminium, métal le plus présent dans l’écorce terrestre (8% de sa masse, derrière l’oxygène 47% et le silicium 28%, mais devant le fer 5% et le calcium 4%), mérite bien un Agro Reporter. En agronomie, l’aluminium est surtout identifié pour la toxicité qu’il peut présenter en sols trop acides. Même si ce phénomène est surtout connu en zones intertropicales, on peut parfois le rencontrer en France. Cette toxicité aluminique fait partie des grands problèmes agronomiques mondiaux (en lien avec l’acidité et l’acidification), comme la salinité, les excès de magnésium ou l’érosion. Nous n’aborderons pas les problèmes que peut engendrer l’aluminium pour la santé humaine et animale (troubles neurologiques dans ses formes solubles ou pulmonaires dans ses formes pulvérulentes) ou pour l’environnement, même s’ils deviennent de plus en plus préoccupants.
- L’aluminium dans les sols
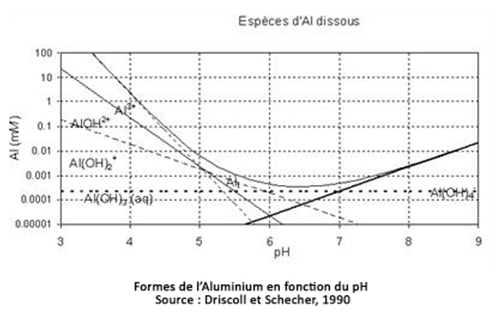
Trop réactif, l’aluminium ne se trouve, dans la nature, qu’associé à d’autres éléments. Plus de 250 minéraux en contiennent, le plus connu étant la bauxite. Ce minerai provient de l'altération de roches contenant des minéraux argileux (ou silicates d'alumine). Le climat tropical favorise cette dégradation (ce qui était le cas dans les Baux-de-Provence pendant le Crétacé, d’où le nom de bauxite). Dans le sol, on peut trouver l’aluminium sous quatre formes principales : les constituants cristallisés (minéraux argileux), les constituants amorphes (hydroxydes, oxydes, silicates alumineux), les constituants incorporés ou chélatés dans la matière organique et les constituants adsorbés plus ou moins fortement sur les complexes, (Al3+ , Al(OH)++, Al(OH)2+). Ce dernier groupe, le plus mobile, va être en relation avec les racines des plantes et intéresse donc l’agronome. On connaît depuis 1904 par les travaux de Veitch (cité par P. Segalen, 1973) la propriété de l’aluminium de se fixer sous forme ionique (Al3+) sur le complexe absorbant des sols acides et son extraction possible par les sels neutres. Cet aluminium est appelé parfois aluminium actif ou mobile, mais le plus souvent aluminium échangeable (Aléch), suivant la terminologie anglo-saxonne.
L’aluminium échangeable n’existe que dans les sols acides et surtout fortement acides (J. Boyer, 1976). La lixiviation des cations, très importante en zone subtropicale à forte pluviométrie, entraîne une désaturation du complexe d’échange et l’acidification du sol. Cette acidification provoque la dissolution des minéraux et la libération des ions Al3+ qui se fixent alors sur les sites vacants du complexe.
L’excès d’aluminium échangeable dans la solution du sol conduit à des toxicités aluminiques pour le végétal, surtout pour des pH eau inférieurs à 5. Si ce risque concerne moins de 1% des sols français, il est présent sur près de 40% des sols agricoles dans le monde (85% pour un pays comme le Rwanda, par exemple), en lien direct avec les niveaux d’acidité (source FAO).
- Effets de l’excès d’aluminium dans les sols
L’excès d’aluminium échangeable inhibe l’activité de la microflore et d’une partie de la microfaune (champignons, bactéries) du sol, même s’il est difficile de distinguer l’effet direct de l’aluminium de celui du pH trop acide. L’aluminium présent sur le complexe absorbant du sol s’oppose, par un effet « tampon », à tout relèvement du pH tant qu’il n’est pas complètement éliminé du complexe. Ainsi, s’il n’est pas tenu compte de l’aluminium dans la politique de chaulage, les apports d’amendement calciques sont souvent très peu efficaces pour le redressement du pH. Enfin, l’aluminium extrait le potassium des sites d’échange et « appauvrit » ainsi le sol (il en est de même pour un amendement calco-magnésien mal géré). Il est par contre facilement déplacé par le calcium.
- L’aluminium et la plante
Si pour certains auteurs l’aluminium est indispensable aux plantes, à très faible dose, il ne préoccupe que pour sa toxicité à forte dose. Cette toxicité est directe (inhibition de la croissance des racines par blocage des divisions cellulaire, voire des organes aériens) et surtout indirecte :
• Complexation du phosphore sous forme de phosphates d’alumine empêchant sa migration dans la plante. Il semble que ce soit l’effet majeur des toxicités aluminiques,
• Antagonisme avec le cuivre et surtout le calcium,
• Synergie avec le manganèse dont il favorise l’absorption, au risque de provoquer des intoxications manganiques. De plus, comme pour l’aluminium, la solubilité du manganèse augmente en sols acides. Les toxicités manganiques et aluminiques sont souvent conjointes et difficilement dissociables.
Il n’y a pas de symptômes globalement spécifiques à la toxicité en aluminium : ralentissements de croissances, blocages, atrophies végétatives (moindre potentiel de production) et, dans les cas graves, mortalité.
L’absorption d’aluminium par les racines est, au départ, un phénomène passif. Puis, au-delà d’une certaine concentration dans la solution, l’absorption devient proportionnelle à la quantité d’aluminium présent (G. Guerrier, 1978). Certains végétaux, comme le théier, sont capables d’absorber, sans symptômes, des quantités très importantes d’aluminium. Il n’existe pas de plantes résistantes, au sens strict, à la toxicité de l’aluminium. Les plantes calcicoles sont souvent les plus sensibles à cette toxicité alors que les plantes acidophiles sont plus tolérantes à l’aluminium. Il existe une grande variabilité génétique sur cette tolérance pour une même espèce. Par exemple, les niveaux en aluminium tolérés entre les génotypes de blé les plus sensibles et les génotypes les plus tolérants diffèrent d’un facteur 10. Ces tolérances sont souvent à déterminisme monogénique (voir plus loin).
- L’aluminium au laboratoire
• Dosage : Le laboratoire LCA réalise la mesure de la concentration en aluminium échangeable par dosage après extraction au KCl 1M (10 g de terre dans 50 ml de solution au KCl à 74.5 g/l) selon la méthode de Jackson. La mesure se fait au pH du sol. Dans ces conditions, seuls les ions Al3+ sont extraits, à l’exclusion des hydroxydes. D’autres solutions d’extraction peuvent être utilisées : acétate d’ammonium tamponné à pH 7, ou solution de chlorure de baryum à pH 8.1 selon la méthode Mehlich. Dans ces cas, l’aluminium extrait provient des ions Al3+ et des hydroxydes d’aluminium. Les mesures issues de deux méthodes différentes ne sont donc pas comparables.
Les laboratoires français ne pratiquent pas en routine, sur les sols continentaux, l’extraction et le dosage de l’aluminium échangeable. Cette mesure sera réservée aux cas particuliers, principalement des sols très acides. La mesure du pHeau, très liée à la teneur en aluminium échangeable permet, dans la majorité des cas, d’anticiper les risques, mais seul le dosage permet de les apprécier finement. Le pH eau n’étant pas une donnée constante de la parcelle (variation saisonnière, fonction de l’humidité du sol, …), le pH KCl lui est souvent préféré comme indicateur (IFDC, Catalist Project, Rwanda 2008) dans les régions ou pays concernés par la toxicité aluminique. Le plus souvent, il s’agit de zones climatiquement homogènes où la pluviométrie, directe ou indirecte par l’irrigation, est supérieure à l’évapotranspiration, avec un courant globalement descendant de l’eau dans le sol (K. Frenken FAO 2012). Les figures 1 et 2 illustrent ce point avec un coefficient de détermination de 68% entre le pH eau et l’aluminium échangeable, alors qu’il est de 82% pour le pH KCl sur la même série de sols provenant de la région de Bururi au Burundi. La nature et la composition des sols et leur richesse naturelle en aluminium expliquent le manque de linéarité.
La qualité de la relation entre les teneurs en aluminium échangeable, pHeau et pHKCl n’a pas été suffisamment étudiée sur les sols français pour pouvoir privilégier telle ou telle mesure du pH, malgré de nombreuses études sur les sols acides . Il n’en demeure pas moins qu’elle mériterait d’être approfondie sur les sols acides ultramarins et métropolitains, irrigués et non irrigués. On considère habituellement qu’il faut atteindre un pH eau supérieur à 5,5 pour que la quasi-totalité de l’aluminium échangeable disparaisse.