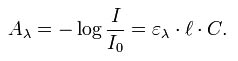La colorimétrie
Dosage par colorimétrie »…. Cette méthode de dosage est couramment utilisée pour quantifier par exemple les ions nitrite, nitrate, ammonium, phosphate, chlorure, chromate (dans le cas de l’analyse du carbone des sols).Présentation de ce grand classique des techniques de laboratoire.
Principe
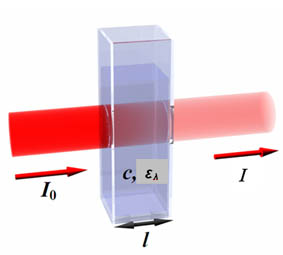
Le dosage colorimétrique repose sur la quantification de produits colorés, issus d’une réaction chimique. Elle n’est possible que lorsque l’intensité de la coloration est proportionnelle à la concentration de l'élément à doser. Les dosages colorimétriques s'appuient sur la loi de Lambert-Beer, exprimée par la relation suivante :
- I / I0 est la transmittance de la solution (sans unité).
- A est l’absorbance ou densité optique à une longueur d'onde λ (sans unité).
- e est l'absorptivité molaire (aussi appelé coefficient d'extinction molaire), exprimée en L·mol-1·cm-1. Elle dépend de la longueur d'onde, la nature chimique de l'entité et la température.
- l est la longueur du trajet optique dans la solution traversée, elle correspond à l'épaisseur de la cuve utilisée
- C est la concentration molaire de la solution (en mol.L-1) et correspond à la valeur à déterminer.
Cette équation est très utile pour la chimie analytique. En effet, si l et e sont connus, la concentration d'une substance peut être déduite de la quantité de lumière transmise par elle.