Le potassium et le magnésium : Différence entre versions
(→Le potassium dans) |
|||
| Ligne 121 : | Ligne 121 : | ||
Certains produits résiduaires, comme les cendres, peuvent être particulièrement riches en potasse. Elles lui ont même donné leur nom : en allemand ''Pottasche'' vient de ''Pott'' (Pot) et de ''Asche'' (Cendre)… | Certains produits résiduaires, comme les cendres, peuvent être particulièrement riches en potasse. Elles lui ont même donné leur nom : en allemand ''Pottasche'' vient de ''Pott'' (Pot) et de ''Asche'' (Cendre)… | ||
| + | |||
| + | |||
| + | == Le magnésium == | ||
| + | |||
| + | <span style="color:#996600 ">Le magnésium est un élément assez mystérieux. Adulé par les producteurs des « cultures spéciales », parfois jusqu’à l’excès en viticulture ou en agriculture biologique, il est le plus souvent ignoré en grandes cultures. | ||
| + | Pourtant, le magnésium fait partie de la cour des « grands », classé comme élément majeur, avec des besoins magnésiens des plantes sensiblement équivalents à ceux du phosphore, de 20 à 50 kg/ha de MgO selon les espèces. | ||
| + | Indispensable à la vie végétale, il constitue, comme le phosphore et le soufre, environ 0,4% de la matière sèche des végétaux. | ||
| + | Le magnésium a, comme le calcium, la spécificité d’avoir des rôles fondamentaux pour le végétal, mais aussi des effets sur le fonctionnement même du sol. Nous développerons ici quelques remarques sur le magnésium au sol. Un article suivant développera les relations avec la plante.</span> | ||
| + | |||
| + | [[Fichier:mg-image1.jpg]] | ||
| + | |||
| + | == Le magnésium dans le sol == | ||
| + | |||
| + | Dans le sol, l’essentiel du magnésium est absorbé sur le Complexe Argilo-Humique ou incorporé aux silicates des argiles. Sa forme ionique, dans la solution du sol, est positive et divalente (Mg++). Exprimée en MgO (oxyde de magnésium), la teneur totale en magnésium est de moins de 1% dans les sols non calcaires et est souvent supérieure à 2% dans les sols calcaires. Pour un sol de densité apparente 1,3 et d’une profondeur de 50cm, cela représente de 30 à 130 tonnes de MgO par hectare. Toutefois la fraction échangeable, plus ou moins disponible pour la plante, dosée au laboratoire après extraction à l’acétate d’ammonium, ne va plus représenter que 0,5 à 10 t /ha dont à peine 10 kg dissous dans la solution du sol. | ||
| + | Le magnésium est peu retenu par le Complexe Argilo Humique et s’avère donc relativement lessivable. Les pertes annuelles représenteraient de 20 à 50 kg/ha de MgO. | ||
| + | On estime qu’un tiers des sols français est excédentaire en MgO (du fait de la nature de la roche mère) et qu’un sol sur six environ est déficitaire (il s’agit le plus souvent de sols squelettiques). | ||
| + | |||
| + | http://www.laboratoirelca.com/download/2012/carteagroreporter26janv.pdf | ||
| + | |||
| + | * '''<span style="color:#CC6633 ">Attention aux antagonismes</span> | ||
| + | |||
| + | Comme les autres cations (c’est-à-dire les éléments minéraux à charge positive), le magnésium en excès va s’opposer au prélèvement par les plantes de tous les autres éléments positifs : calcium, potassium mais aussi tous les oligo-éléments (sauf le molybdène). Ainsi l’excès de magnésie dans un sol est un facteur d’aggravation des phénomènes chlorotiques. | ||
| + | A l’inverse, tout excès de K2O ou CaO (voire Na2O) va limiter l’assimilabilité du magnésium. Les équilibres des cations sur la CEC et les rapports K/Mg et Ca/Mg sont donc des éléments importants à prendre en compte dans l’interprétation d’une analyse de terre et la construction d’un plan de fertilisation. Pour la majorité des espèces, un rapport K/Mg correct est compris entre 0,8 et 1,2. | ||
| + | |||
| + | |||
| + | * '''<span style="color:#CC6633 ">Principaux effets sur le sol </span> | ||
| + | |||
| + | '''Effet sur le pH''' : | ||
| + | |||
| + | la magnésie, c’est-à-dire l’oxyde de magnésium MgO, est particulièrement efficace pour redresser le pH d’un sol : 1,4 fois plus que CaO. Ainsi, la Valeur Neutralisante (1) d’une dolomie (à 30% de CaO et 21% de MgO) est de 59, alors qu’elle ne serait que de 51 pour un carbonate de calcium dosant 51% de CaO. Mais cette efficacité est souvent dangereuse. En effet, tout excès de MgO au sol va limiter la disponibilité du calcium, par antagonisme. On rencontre assez fréquemment des sols à pH correct grâce à leur richesse magnésienne, mais où il est nécessaire de continuer à apporter du calcium, sous forme très soluble (pour ne pas augmenter le pH), l’excès de MgO bloquant le calcium pour la nutrition de la plante. L’amendement avec des produits calco-magnésiens est donc à utiliser avec précaution, sur la base d’une analyse de sol. | ||
| + | |||
| + | |||
| + | '''Effet sur la structure du sol''' : | ||
| + | |||
| + | dans le même ordre d’idée, l’excès de MgO participe à « défloculer » le sol, et donc à dégrader sa structure (moindre prise en mottes). En effet, le magnésium prend la place du calcium sur le complexe argilo-humique, mais sans en avoir tous les rôles agglomérants. | ||
| + | |||
| + | |||
| + | '''Effet sur la salinité''' : | ||
| + | |||
| + | par ses caractéristiques ioniques et atomiques, le magnésium augmente la salinité des sols. Si ce problème est encore peu fréquent en France, tant que la pluviométrie reste suffisante (sauf pour certains sols maraîchers ou en pépinières), il est particulièrement grave en Afrique du Nord où l’excès de magnésium peut empêcher la culture de certaines espèces. La mesure de la conductivité sur l’analyse de sol est donc une donnée indispensable pour certains pays ou végétaux. | ||
| + | |||
| + | |||
| + | * '''<span style="color:#CC6633 ">Conditions d’assimilation :</span> | ||
| + | |||
| + | L’assimilation du magnésium par les racines est beaucoup moins soumise à une bonne porosité du sol que celle du phosphore. De même, son passage dans le végétal est moins lié à la disponibilité hydrique que celui du potassium. | ||
| + | Les contraintes majeures de l’assimilation du magnésium, s’il est présent au sol, sont donc surtout les excès éventuels des autres cations, potassium et calcium. | ||
| + | Mais le magnésium a la caractéristique d’être un élément « climatique ». Sa migration interne dans le végétal est totalement sous la dépendance de la régularité thermique. Ainsi, dans les périodes de forts écarts thermiques, fréquents en fin de printemps, il n’est pas rare sur les espèces sensibles, la vigne par exemple, d’observer des symptômes de carences magnésiennes, sans que cela ne soit un problème de disponibilité au sol. | ||
| + | |||
| + | |||
| + | ''(1) Valeur Neutralisante : La valeur neutralisante (VN) d’un produit, en particulier d’un amendement basique, s’exprime par la masse (en kg) d’oxyde de calcium (CaO) qui a la même capacité de neutralisation que 100kg du produit. On la mesure par action d’un acide fort (HCl). Un amendement titrant 54% de CaO a une valeur neutralisante de 54. | ||
| + | Remarque : La valeur neutralisante est une mesure chimique conventionnelle qui exprime la capacité potentielle d’un amendement basique à neutraliser l’acidité d’une terre. L’expression de ce potentiel dépend des conditions de milieu, et le cas échéant, de la finesse et de la dureté des particules d’amendement. Source : COMIFER, Groupe chaulage.'' | ||
Version du 27 avril 2012 à 11:59
Potassium, Magnésium
Avec le Calcium et le Sodium, ces 2 éléments constituent les principaux cations (ou bases) échangeables.
Sommaire
Le potassium
Bien qu’il ne tienne pas souvent le devant de la scène, le potassium est un acteur de premier plan. Seul élément majeur n’intervenant pas dans les fonctions structurales ou plastiques du végétal, il est par contre indispensable au fonctionnement même de la plante :
- maintien des équilibres électriques et de l’hydratation cellulaire : alimentation en eau, migration des glucides issus de la photosynthèse, régulation de l’azote…
- activation de la plupart des cycles enzymatiques : activation des réactions chimiques
Cet élément indispensable à la croissance et au développement des plantes, permet donc à la fois des synthèses dans les cellules, des transports entre cellules végétales, la régulation de l’eau dans la plante, la résistance au stress…
Figure 1 : Teneur en potassium échangeable (mg/kg) de l’horizon de surface des sols agricoles Source : Gis Sol (BDAT), période début 2000 à fin 2004
Le potassium dans le sol
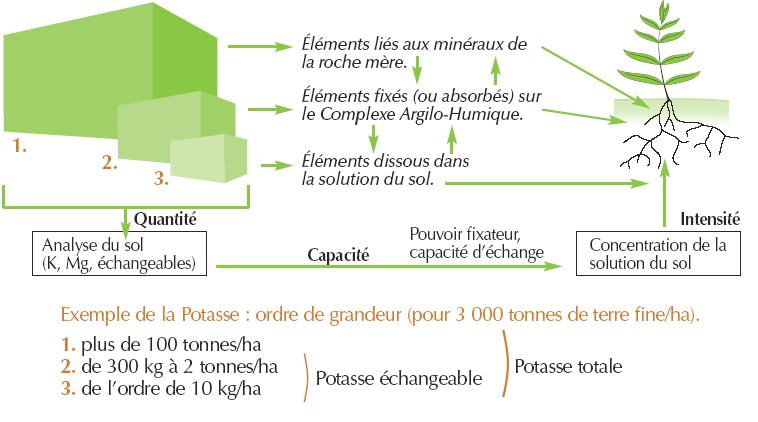
Dans le sol, le potassium se trouve sous quatre principaux états :
- Le potassium non échangeable : lié aux minéraux silicatés (de type mica et feldspath), aux argiles proches des micas (argiles de type illite), c’est la forme majoritaire. Cette forme constitue une réserve utilisable à long terme ;
le potassium est libéré progressivement par l’altération des minéraux, sous l’effet de l’activité biologique des sols (« attaque » des racines, de leurs sécrétions, de leurs mycorhizes, action du climat…). Directement liées à la nature minéralogique des sols, les teneurs en potassium non échangeable sont forcément très variables dans les sols français. Par voie de conséquence, les teneurs en potassium échangeables suivent aussi ces variations (Figure 1).
- Le potassium à l’intérieur des réseaux cristallins : les argiles dont les feuillets ont la capacité de s’écarter et de se rétracter dans certaines conditions (hydratation, apport de chaux…), permettent aux cations K+ situés à leur surface de se fixer à l’intérieur des feuillets, sous une forme non échangeable. Ce phénomène, appelé « rétrogradation » est observé pour les micas, illites, vermiculites, smectites, et est réversible. Ces argiles présentent un fort pouvoir fixateur vis-à-vis du potassium, mais elles peuvent aussi en restituer sous une forme échangeable.
- Le potassium adsorbé : c’est la forme facilement utilisable, à l’état d’ions K+ dans la solution du sol ou adsorbés sur le complexe argilo-humique. L’équilibre entre le potassium de la solution du sol et celui qui est adsorbé sur le complexe d’échange cationique constitue le potassium échangeable ou assimilable.
- Le potassium renfermé dans les matières organiques : les plantes, après avoir prélevé et absorbé le potassium pour leur maturation, excrètent ensuite celui-ci, contenu dans leurs sucs, par leurs racines et par leurs feuilles. Après leur mort, la décomposition des résidus végétaux libère encore des cations K+ : c’est la minéralisation primaire.
Bien que présent dans le sol sous plusieurs formes, le potassium n’est assimilé par les végétaux que sous la forme ionique K+. La proportion de K+ échangeable est finalement infime (1 à 2 % du potassium total), tant dans la solution du sol que sur le complexe argilo-humique, par rapport aux autres formes naturellement présentes dans le sol : plus de 99 % de cette forme K+ est adsorbée sur le complexe, et une quantité minime se trouve en solution.
Des échanges entre la phase solide et la phase liquide (solution) du sol ont lieu en permanence, permettant le prélèvement de cet élément par les racines. On estime que seulement 10 à 20% de la nutrition des cultures est assurée à partir du K+ échangeable (en solution et adsorbé). Le reste des besoins de la plante en potassium est donc assuré par les autres sources disponibles (libération par les matières organiques, par l’écartement des feuillets d’argile, par l’altération des minéraux silicatés potassiques).
Au laboratoire
Méthode Normalisée NF X 31-108
- Extraction (à l’acétate d’ammonium) et dosages identiques au Calcium.
N.B.: le dosage par spectrométrie s’effectue à la longueur d’onde caractéristique de chaque élément.
- Expression des résultats :
Signification et bases de l’interprétation de l’analyse
Tout comme pour le phosphore, la fertilisation potassique ne se raisonne pas à partir de la teneur totale en potassium du sol, mais par une approche d’élément disponible : ainsi, le potassium est dosé au laboratoire, après une extraction par une solution d'acétate d'ammonium, par spectrométrie (norme NF X31-108). Cet extractif est censé reproduire le fonctionnement des racines et représenter la part de potassium extractible par les plantes.
Le principe de raisonnement de la fertilisation potassique est le même que celui de la fertilisation phosphatée. Au LCA, partant d'une approche de type Comifer, quatre critères principaux sont pris en compte pour le calcul d’une dose d’apport, ou proposer un conseil d’impasse le cas échéant :
- L’exigence des cultures (définissant des seuils d’impasse) : les espèces cultivées ont des sensibilités différentes à la carence en potassium : par exemple, la betterave et la pomme de terre sont beaucoup plus exigeantes en potassium que le blé ou l’orge. Ainsi, une teneur de potassium échangeable dans un sol de 150 mg/kg peut être satisfaisante pour un blé tendre, mais nécessitera un complément pour un colza
- La teneur du sol en potassium échangeable (mesurée par l’analyse de terre)
- Le passé récent de fertilisation (impasses ou non pendant les 3 dernières années)
- La gestion des résidus de culture du précédent (enfouis ou exportés)
Là encore, une place importante est donnée au sol, en intégrant l’appréciation du pouvoir fixateur du sol vis à vis du potassium, la capacité d’exploration du sol par les racines et le passé récent de fertilisation.
Le potassium est un élément mobile, donc susceptible de migrer dans les horizons plus profonds, ainsi que d’être entraîné en dehors de la parcelle (pertes par lessivages importantes en sol sableux). Cet aspect, lié à la texture du sol, est aussi pris en considération dans l’interprétation de l’analyse.
| A noter : |
|
Compléter efficacement l’offre en potassium du sol
Le choix de la dose et du fractionnement de la fertilisation potassique doit tenir compte de quelques données agronomiques de base et du climat :
- la texture du sol : sur un sol filtrant, par exemple, les risques de lessivage seront beaucoup plus importants et obligeront souvent à fractionner les apports de potassium pour limiter les pertes et optimiser les apports.
- la richesse cationique du sol : les risques de moindre efficacité du potassium apporté seront beaucoup plus élevés en sol saturés en calcium ou magnésium.
- le niveau de fumure azoté : l’azote et le potassium ayant un rôle inverse dans le végétal, le rapport N/K2O de la fertilisation (à moduler selon les stades physiologiques) est à la base de la construction d’un plan de fertilisation, surtout en maraîchage et arboriculture.
- la pluviométrie (ou la présence d’un système d’irrigation) : les prélèvements nutritionnels et le transport des minéraux se faisant dans un milieu aqueux, tous les éléments seront pénalisés par un manque d‘eau. Le potassium, dont l’assimilation est dite passive (c’est à dire très liée au niveau et à la régularité du flux hydrique dans le végétal) est particulièrement pénalisé en sol sec. A l’inverse, dans les situations de pluviométrie élevée, cet élément mobile peut se trouver entraîné en profondeur limitant l’efficacité de l’apport.
Même si le potassium est indispensable au végétal, une surfertilisation peut être néfaste pour la culture, par phénomènes d’antagonisme, selon divers mécanismes :
- antagonisme par concurrence ionique : une augmentation de la concentration de la solution du sol en potassium induit une augmentation d’absorption de potassium par la racine au détriment du magnésium et du calcium. De même, un excès de disponibilité en potassium accentue les phénomènes chlorotiques en sols sensibles en limitant la disponibilité du fer et manganèse.
- appauvrissement du complexe par déplacement d’ions : les ions K+ en excès prennent la place des ions Ca2+ et Mg2+ sur le complexe argilo-humique. Ces derniers sont alors exposés au lessivage : c’est l’action décalcifiante et antimagnésienne des engrais potassiques ;
Il faut de plus noter le phénomène d’absorption sélective des ions par les racines : les végétaux semblent « préférer » les ions K+ aux ions Ca2+.
Bien choisir son engrais potassique
Les engrais ont pour fonction principale d’apporter aux plantes des éléments directement disponibles pour leur nutrition, quand le sol est déficient.
Pour pouvoir être mis sur le marché, ils doivent répondre à une norme française (par exemple NF U 42-001 pour les engrais minéraux simples et composés, engrais organiques simples et composés, engrais organo-minéraux composés) ou être conformes au règlement européen (CE) n° 2003/2003, et contenir plus de 3 % d’un élément majeur (N, P2O5 ou K2O).
Un certain nombre d’informations doit être précisé sur l’étiquette du produit, comme la teneur en masse des différents éléments fertilisants présents, les formes présentes et la solubilité associée.
Les engrais potassiques sont de plusieurs natures (sels de potasse seuls ou en mélange / association engrais P naturels + solution K / Patenkali…) et on utilisera l’engrais adapté aux besoins : engrais binaires P-K, engrais ternaire N-P-K … Parmi les engrais composés, il existe une multitude de dosages possibles, selon les marques, et leur choix dépendra des usages prévus.
Les engrais potassiques ont tous la même efficacité du point de vue du potassium : le choix s’effectuera plutôt selon la nature de l’anion associé (sulfate ou chlorure par exemple) : pour les productions sensibles au chlore (petits fruits rouges, fraisiers, haricots, melons...), la mention “pauvre en chlore” (moins de 2% de chlore Cl) garantit l’absence de chlorure de potassium.
En complément, la marque SK indique que le potassium est exclusivement sous la forme de sulfate de potassium dans l’engrais composé et apporte du soufre directement assimilable.
Le chlorure de potasse présente, par ailleurs, un indice de salinité 2 à 3 fois plus élevé que le nitrate ou le sulfate de potasse ; il sera donc à éviter dans la majorité des sols à risque de salinité ou pour les cultures sensibles.
L’utilisation de produits organiques (boues de stations d’épuration, composts, effluents d’élevage, …) est également une source importante de potassium à ne pas négliger. Contrairement à l’azote ou au phosphore dosés dans ces produits organiques, la disponibilité en K2O est supposée totale, le potassium ne passant pas par la phase organique du sol.
Certains produits résiduaires, comme les cendres, peuvent être particulièrement riches en potasse. Elles lui ont même donné leur nom : en allemand Pottasche vient de Pott (Pot) et de Asche (Cendre)…
Le magnésium
Le magnésium est un élément assez mystérieux. Adulé par les producteurs des « cultures spéciales », parfois jusqu’à l’excès en viticulture ou en agriculture biologique, il est le plus souvent ignoré en grandes cultures. Pourtant, le magnésium fait partie de la cour des « grands », classé comme élément majeur, avec des besoins magnésiens des plantes sensiblement équivalents à ceux du phosphore, de 20 à 50 kg/ha de MgO selon les espèces. Indispensable à la vie végétale, il constitue, comme le phosphore et le soufre, environ 0,4% de la matière sèche des végétaux. Le magnésium a, comme le calcium, la spécificité d’avoir des rôles fondamentaux pour le végétal, mais aussi des effets sur le fonctionnement même du sol. Nous développerons ici quelques remarques sur le magnésium au sol. Un article suivant développera les relations avec la plante.
Le magnésium dans le sol
Dans le sol, l’essentiel du magnésium est absorbé sur le Complexe Argilo-Humique ou incorporé aux silicates des argiles. Sa forme ionique, dans la solution du sol, est positive et divalente (Mg++). Exprimée en MgO (oxyde de magnésium), la teneur totale en magnésium est de moins de 1% dans les sols non calcaires et est souvent supérieure à 2% dans les sols calcaires. Pour un sol de densité apparente 1,3 et d’une profondeur de 50cm, cela représente de 30 à 130 tonnes de MgO par hectare. Toutefois la fraction échangeable, plus ou moins disponible pour la plante, dosée au laboratoire après extraction à l’acétate d’ammonium, ne va plus représenter que 0,5 à 10 t /ha dont à peine 10 kg dissous dans la solution du sol. Le magnésium est peu retenu par le Complexe Argilo Humique et s’avère donc relativement lessivable. Les pertes annuelles représenteraient de 20 à 50 kg/ha de MgO. On estime qu’un tiers des sols français est excédentaire en MgO (du fait de la nature de la roche mère) et qu’un sol sur six environ est déficitaire (il s’agit le plus souvent de sols squelettiques).
http://www.laboratoirelca.com/download/2012/carteagroreporter26janv.pdf
- Attention aux antagonismes
Comme les autres cations (c’est-à-dire les éléments minéraux à charge positive), le magnésium en excès va s’opposer au prélèvement par les plantes de tous les autres éléments positifs : calcium, potassium mais aussi tous les oligo-éléments (sauf le molybdène). Ainsi l’excès de magnésie dans un sol est un facteur d’aggravation des phénomènes chlorotiques. A l’inverse, tout excès de K2O ou CaO (voire Na2O) va limiter l’assimilabilité du magnésium. Les équilibres des cations sur la CEC et les rapports K/Mg et Ca/Mg sont donc des éléments importants à prendre en compte dans l’interprétation d’une analyse de terre et la construction d’un plan de fertilisation. Pour la majorité des espèces, un rapport K/Mg correct est compris entre 0,8 et 1,2.
- Principaux effets sur le sol
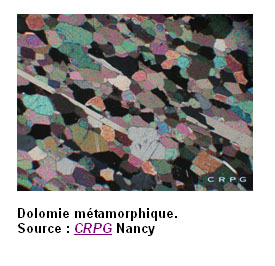
Effet sur le pH :
la magnésie, c’est-à-dire l’oxyde de magnésium MgO, est particulièrement efficace pour redresser le pH d’un sol : 1,4 fois plus que CaO. Ainsi, la Valeur Neutralisante (1) d’une dolomie (à 30% de CaO et 21% de MgO) est de 59, alors qu’elle ne serait que de 51 pour un carbonate de calcium dosant 51% de CaO. Mais cette efficacité est souvent dangereuse. En effet, tout excès de MgO au sol va limiter la disponibilité du calcium, par antagonisme. On rencontre assez fréquemment des sols à pH correct grâce à leur richesse magnésienne, mais où il est nécessaire de continuer à apporter du calcium, sous forme très soluble (pour ne pas augmenter le pH), l’excès de MgO bloquant le calcium pour la nutrition de la plante. L’amendement avec des produits calco-magnésiens est donc à utiliser avec précaution, sur la base d’une analyse de sol.
Effet sur la structure du sol :
dans le même ordre d’idée, l’excès de MgO participe à « défloculer » le sol, et donc à dégrader sa structure (moindre prise en mottes). En effet, le magnésium prend la place du calcium sur le complexe argilo-humique, mais sans en avoir tous les rôles agglomérants.
Effet sur la salinité :
par ses caractéristiques ioniques et atomiques, le magnésium augmente la salinité des sols. Si ce problème est encore peu fréquent en France, tant que la pluviométrie reste suffisante (sauf pour certains sols maraîchers ou en pépinières), il est particulièrement grave en Afrique du Nord où l’excès de magnésium peut empêcher la culture de certaines espèces. La mesure de la conductivité sur l’analyse de sol est donc une donnée indispensable pour certains pays ou végétaux.
- Conditions d’assimilation :
L’assimilation du magnésium par les racines est beaucoup moins soumise à une bonne porosité du sol que celle du phosphore. De même, son passage dans le végétal est moins lié à la disponibilité hydrique que celui du potassium. Les contraintes majeures de l’assimilation du magnésium, s’il est présent au sol, sont donc surtout les excès éventuels des autres cations, potassium et calcium. Mais le magnésium a la caractéristique d’être un élément « climatique ». Sa migration interne dans le végétal est totalement sous la dépendance de la régularité thermique. Ainsi, dans les périodes de forts écarts thermiques, fréquents en fin de printemps, il n’est pas rare sur les espèces sensibles, la vigne par exemple, d’observer des symptômes de carences magnésiennes, sans que cela ne soit un problème de disponibilité au sol.
(1) Valeur Neutralisante : La valeur neutralisante (VN) d’un produit, en particulier d’un amendement basique, s’exprime par la masse (en kg) d’oxyde de calcium (CaO) qui a la même capacité de neutralisation que 100kg du produit. On la mesure par action d’un acide fort (HCl). Un amendement titrant 54% de CaO a une valeur neutralisante de 54.
Remarque : La valeur neutralisante est une mesure chimique conventionnelle qui exprime la capacité potentielle d’un amendement basique à neutraliser l’acidité d’une terre. L’expression de ce potentiel dépend des conditions de milieu, et le cas échéant, de la finesse et de la dureté des particules d’amendement. Source : COMIFER, Groupe chaulage.