Les oligo-éléments
Les Oligo-éléments Cuivre, Zinc, Manganèse, Fer
Sommaire
Au laboratoire
- Les oligos EDTA (cuivre, zinc, manganèse) : sont dosés après extraction à l’acétate d’ammonium en présence d’EDTA (sel de l’acide éthylène diaminotétracétique).
Méthode normalisée NF X 31-120.
1. a) 5 g de terre fine
b) 50 ml de solution d’extraction à l’EDTA
2. Agitation 2h
3. Centrifugation
4. Mesure par spectrométrie plasma (ICP)
Expression des résultats :
en éléments Cu, Zn, Mn, en mg/kg de terre fine.
- Le fer peut être déterminé par différentes méthodes d’extraction :
1. Fer assimilable = méthodologie identique à la détermination du Cu, Zn, Mn décrite ci-dessus.
N.B. : l’EDTA peut, dans certains cas, être remplacé par une solution d’extraction au DTPA.
2. Fer échangeable = extraction par l’acétate d’ammonium à pH neutre, de la même manière que le potassium, calcium et magnésium échangeables.
3. Fer facilement extractible (suivant la méthode Juste) = extraction à l’oxalate d’ammonium.
N.B. : le fer facilement extractible est utilisé pour le calcul de l’indice de pouvoir chlorosant (IPC) sur sol calcaire (calcaire total ≥ 10 %).
Expression des résultats : en éléments Fe en mg/kg de terre fine.
Signification agronomique
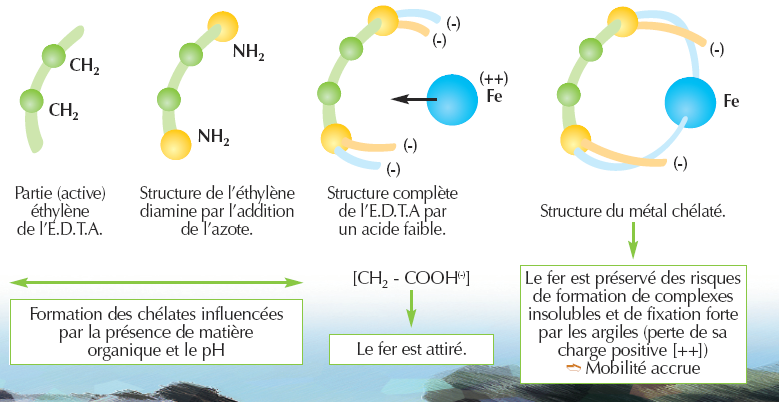
Principe de Chélation - exemple du fer :
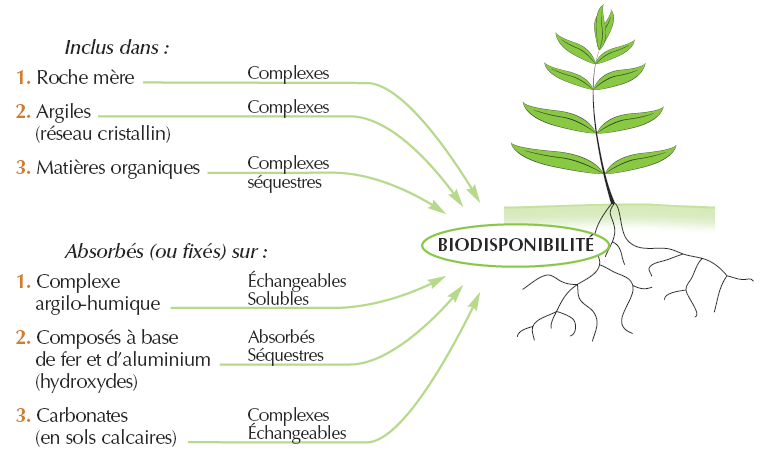
Site de présence des Oligo-éléments
| Quantités d’éléments totaux/ha |
Quantités d’éléments disponibles/ha |
Quantités d’éléments absorbés par la plante/ha | |
Zinc (Zn) |
40 à 1200 kg |
1 à 30 kg |
40 à 1200 g |
Cuivre (Cu) |
10 à 1500 kg |
2 à 40 kg |
10 à 1500 g |
Manganèse (Mn) |
400 à 15000 kg |
8 à 400 kg |
400 à 15000 g |
Fer (Fe) |
0,8 à 400 tonnes |
40 à 1000 kg |
0,8 à 400 kg |
Interprétation des résultats
Bases générales
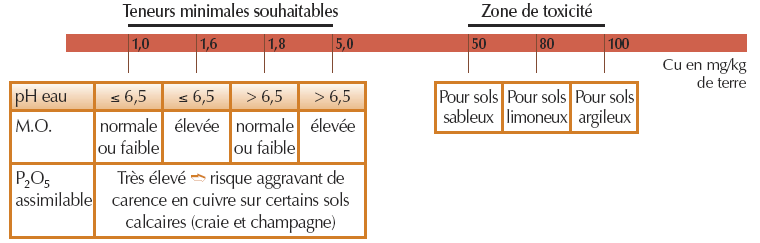
- Pour le cuivre EDTA
Le dosage du cuivre échangeable (à l’acétate d’ammonium) est une méthode plus pertinente pour apprécier les risques de toxicité.
N.B.: le rapport 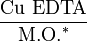 peut être utilisé pour diagnostiquer des situations à risque de carence en cuivre, en particulier sur sols argilo-calcaires.
peut être utilisé pour diagnostiquer des situations à risque de carence en cuivre, en particulier sur sols argilo-calcaires.
Exemple pour terres de groies, craie ou champagne si 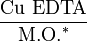 < 0,4
< 0,4
* M.O. = Matières Organiques
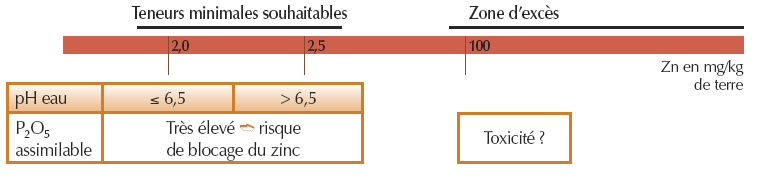
- Pour le zinc EDTA (grandes cultures)'
- Pour le zinc EDTA (vigne et arboriculture)
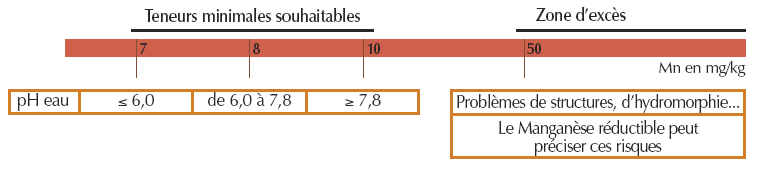
- Pour le manganèse EDTA
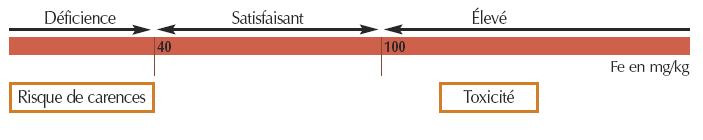
- Pour le fer EDTA
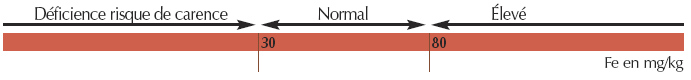
- Pour le fer oxalate (facilement extractible)
N.B.: pour le choix du porte-greffe en viticulture, le fer facilement extractible et le calcaire actif sont utilisés pour le calcul de l’indice de pouvoir chlorosant (IPC). c.f. : [1]
| A noter : |
|
Les Oligo-éléments extraits à l’EDTA ont un intérêt limité en viticulture :
|
Appréciation des Oligo-éléments dans les sols
| Cuivre (Cu) |
Zinc (Zn) | |||
Milieu favorable à la déficience |
|
| ||
Symptômes de carence |
Difficilement détectables, sauf dans les cas avancés.
Décoloration blanche des pointes des jeunes feuilles des céréales, puis trouble de l’épiaison. Sur maïs, feuilles terminales manquant de turgescence. Généralement les jeunes pousses sont les plus touchées. |
Chlorose internervaire, réduction de taille et malformation des feuilles et rameaux. | ||
Plantes sensibles |
Blé, orge, avoine, luzerne, laitue, tabac, carotte, oignon | Maïs, sorgho, lin, haricot, pommier, pêcher | ||
Doses d’apport au sol |
5kg cuivre (Cu)/ha | 8 à 10 kg zinc (Zn)/ha | ||
| Formes utilisables en fertilisation |
Sources |
% Cu apporté |
Sources |
% Zn apporté |
| Sulfate de Cu (stable)
Bouillie bordelaise Oxydes de Cu Oxychlorures de Cu Chélates de Cu |
25 12 70 à 88 50 9 à 13 |
Sulfate de Zn
Oxydes de Zn Nitrate de Zn Chélates de Zn |
22 75 15 9 à 14 | |
| A noter : |
|
| Manganèse (Mn) |
Fer (Fe) | |||
Milieu favorable à la déficience |
|
| ||
Symptômes de carence |
Proche de ceux de la carence en magnésie, mais atteignant d’abord les jeunes feuilles.
Au stade avancé, seules les nervures et les zones adjacentes restent vertes. |
Début : pâleur des feuilles puis chlorose internervaire nette, réseau de nervures vertes finement réticulé.
Stade suivant : toute la feuille est atteinte y compris les nervures secondaires, voire principales. Apparition de zones nécrotiques, chute prématurée des feuilles en arboriculture et en vigne. | ||
Plantes sensibles |
Avoine, blé, sorgho, betterave sucrière, haricot, laitue, pois, soja, pommier, pêcher, vigne | Haricot, soja, chou, betterave sucrière, tomate, poirier, pêcher, prunier, vigne, citrus | ||
Doses d’apport au sol |
20 kg manganèse (Mn)/ha | 100 à 600 kg fer (Fe)/ha, selon les cultures | ||
| Formes utilisables en fertilisation |
Sources |
% Mn apporté |
Sources |
% Fe apporté |
| Sulfate de Mn
Oxydes de Mn Chlorures de Mn Chélates de Mn
|
26 à 28 40 à 68 27 12 16 (+ 2 % Zn) 20 |
Sulfate de fer
Oxydes de fer Chélates de fer |
2 à 23 69 à 77 5 à 14 | |
| A noter : |
|
zoom sur le Fer
La mythologie grecque ne se trompe pas quand elle réunit dans la figure divine d’Héphaïstos, le feu, la forge et les volcans. Le fer, cet élément courant de notre vie quotidienne, vient du cœur de la terre. Nous lui devons des découvertes capitales à l’origine de grandes avancées dans l’histoire humaine. Au Xème siècle avant notre ère, en Europe, l’ « âge de fer » permet ainsi un développement de l'agriculture grâce à des techniques nouvelles : l'araire à soc de fer remplace l'araire en bois et permet de labourer plus profondément.
Nous le connaissons aussi comme oligo-élément, classé parmi les sels minéraux indispensables à notre alimentation (contre l’anémie par exemple). Mais il peut se révéler toxique sous certaines formes. On le voit, le fer est étroitement lié à la physiologie animale et végétale : on le retrouve aussi bien au centre du noyau de notre hémoglobine qu’au cœur du fonctionnement de la photosynthèse.
C’est enfin un excellent indicateur coloré utilisé par les pédologues pour apprécier l’état d’oxydation des sols. Ces nombreuses facettes du fer justifiaient bien deux numéros de l’Agro Reporter ! Dans cette première partie, nous nous intéresserons à la genèse du fer dans les sols agricoles.
- Dur comme fer
Le fer est l’oligo-élément le plus abondant dans les sols. Quatrième élément en poids de l’écorce terrestre (environ 5 %), il vient après l’oxygène, le silicium et l’aluminium. Présent dans presque toutes les roches de surface, dans tous les sols, il constitue en grande partie le centre de la terre. En tant que minéral, le fer doit subir un ensemble complexe de processus (échange, hydrolyse, mise en solution, oxydation et réduction, absorption, chélation …) pour aboutir à la formation d’un sol. On admet que les minéraux riches en fer doivent subir une décomposition complète en leurs différents constituants pour passer à l’état d’ions avant de se recombiner pour donner naissance aux minéraux du sol. L’eau est un agent primordial de ces opérations qui permettent le passage du fer à l’état de minéral au fer constituant du sol.
- Indicateur coloré
Les modifications de l’état du fer, et notamment les teintes du sol induites par la présence de fer, constituent pour les agronomes et les pédologues un excellent indicateur de l’état d’aération du milieu. En milieu réducteur et pauvre en oxygène, le fer est bivalent (Fe++) sous la forme d’oxyde ferreux, d’hydroxyde ferreux, de carbonate ferreux ou de sulfure de fer. Dans ces sols généralement asphyxiants par excès d’eau (sols hydromorphes), les oxydes ferreux se déposent en taches de gley caractéristiques de couleur gris vert ou gris bleuté.
En milieu aéré, le fer est trivalent (Fe+++) et prend la forme d’oxyde ferrique ou d’hydroxyde ferrique. Les colorations caractéristiques de ces milieux sont des teintes rouille du fer oxydé Fe2O3.
- Le fer sous toutes ses formes
Dans le sol, le fer peut se présenter sous différentes formes :
- Une forme colloïdale dans laquelle l’hydroxyde ferrique(Fe(OH)3 ou Fe(OH)2+ ou Fe(OH)++)peut être combiné au complexe argilo-humique. C’est surtout cette forme du fer qui donne à l’argile sa couleur : soit brune si l’oxyde est très hydraté (sous climats humides), soit brun-rouge à rouge si l’oxyde est peu hydraté ou même déshydraté (sous climats méditerranéens et tropicaux). C’est également sous cette forme d’oxyde ferreux que peuvent se fixer les anions phosphates. Le fer ainsi combiné est insoluble, et donc non échangeable.
- Une forme soluble et échangeable : en milieu réducteur pauvre en oxygène, le fer prend la forme bivalente ou ferreuse. L’acidité favorise cette réduction. Bien que le fer soit assimilable sous cette forme, le milieu réducteur est défavorable à l’activité des racines et des microorganismes et l’excès de fer peut même devenir toxique. En outre, l’abondance des ions Fe++ contribue à maintenir l’acidité du sol : On comprend que les sols qui souffrent d’un excès d’eau soient aussi fréquemment des sols trop acides…
- Une forme cristalline : l’oxyde ferrique peut se cristalliser et former, autour des grains de sable, soit un simple film, soit un véritable ciment qui réunit ces grains en concrétions jusqu’à former, dans certaines conditions, de véritables bancs rocheux. Dans les régions arrosées, après migration des différentes formes de fer, la cristallisation peut conduire à la formation d’alios (véritable cuirasse de grès ferrugineux) fréquente dans les sols podzoliques installés sur roche mère sableuse.
- Une forme pseudo-soluble : le fer à l'état ferreux, ou ferrique, peut s'associer à la silice ainsi qu'à divers produits organiques, comme des protéines (caséine, gélatine, …), des acides minéraux (acide phosphorique, …), des amino-acides (acide aspartique, …), des hydroxyacides (acide lactique, malonique, …), et en particulier les acides humiques et fulviques. Il forme ainsi des complexes pseudo-solubles, c'est-à-dire que le fer est sous une forme colloïdale dispersée, et donc mobile. Parmi tous ces produits, certains sont susceptibles de former des complexes, d’autres des chélates avec Fe. C’est sous cette forme que le fer est généralement assimilé par les plantes et qu’il peut migrer soit vers le bas pour les sols bruns lessivés, soit vers le haut dans les sols rouges. En sols acides et riches en matières organiques solubles, il se forme des complexes ferro-humiques migrant facilement en profondeur, caractéristiques des sols podzoliques. Ces phénomènes de chélation sont particulièrement importants : c’est l’oligo-élément le plus susceptible de se trouver en concentration importante sous forme chélatée.
Le rôle du fer dans la plante
- L’assimilabilité du fer
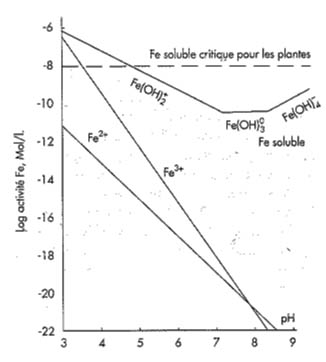
Dans les sols normalement aérés, le fer se retrouve essentiellement à l’état le plus oxydé, c'est-à-dire à l’état ferrique Fe+++. La solubilité de Fe dans les sols dépend donc surtout de la solubilité des oxydes ferriques, elle-même fortement influencée par le pH des sols.
Solubilité de Fe inorganique en fonction du pH et du niveau critique Fe pour les plantes (d’après Lindsay, 1984)
Dans les conditions de sol réductrices, le fer se trouve essentiellement à l’état ferreux Fe++. La solubilité du fer est donc accrue ainsi que sa disponibilité. Toutefois, lorsque les conditions de sols deviennent asphyxiantes, par exemple dans les zones tassées des parcelles, l’activité des racines est perturbée et l’absorption du fer réduite. D’autres facteurs augmentent les risques de chlorose tels que l’accumulation de métaux dans le sol comme le manganèse, le zinc ou le cuivre. L’absorption du fer est aussi très sensible à l’influence d’autres cations tels que le potassium, le magnésium et le calcium.
En cas de chlorose ferrique en viticulture, on observe une augmentation très significative de la teneur en phosphore, potassium, magnésium et une diminution du calcium dans les feuilles atteintes de chlorose (1) par rapport aux autres feuilles non chlorosées qui est attribuée à une formation in suffisante de glucides. A contrario, certains facteurs peuvent augmenter la solubilité Fe telles que les conditions d’oxydo-réduction et la présence de chélatants.
Enfin, l’exsudation d’agents complexants par les plantes dans la zone racinaire est susceptible d’augmenter la solubilité totale du fer dans les sols. Les différences variétales peuvent être importantes à cet égard.
- Absorption du fer
L’absorption du fer sous forme Fe++ ou dans un certaine mesure sous forme chélatée est liée à la capacité qu’ont les racines d’abaisser le pH et de réduire Fe+++ en Fe++ dans la rhizosphère. Certaines plantes et prioritairement les dicotylédones réagissent en induisant des réactions de solubilisation de Fe à la surface racinaire en :
- libérant des ions H+ (entraînant une baisse de pH), - émettant des substances réductrices dans le milieu pour permettre l’accroissement du rythme de réduction de Fe+++ à Fe++ , - augmentant la production d’acide organique (citrique en particulier) et d’autres substances, ayant des propriétés de chélation du fer, alors que les graminées vont réagir en : - produisant des phytosidérophores. (2)
- Les réponses au stress
Les variétés diffèrent quant à leur aptitude à absorber le fer notamment en situation de stress. Les espèces efficaces pour absorber cet élément répondent à une trop faible assimilabilité du fer en développant des réactions qui permettent d’en augmenter l’absorption. Les espèces inefficaces n’ont pas cette faculté d’induire une réponse au stress. Ces différences ont été largement utilisées par les sélectionneurs en arboriculture fruitière et en viticulture surtout : on va chercher à créer des associations de porte-greffes efficaces vis-à-vis de l’absorption de Fe et de scions capables de produire des fruits de la qualité recherchée.
- Les rôles du fer
Parmi tous les oligo-éléments, le fer est celui dont les plantes ont le besoin quantitativement le plus élevé. Il entre dans la composition de plusieurs enzymes à hème (3) et sans hème, notamment catalase, peroxydase et cytochrome oxydase. On retiendra que le fer joue un rôle essentiel dans la respiration, la synthèse de chlorophylle et la photosynthèse. Par conséquent, les plantes souffrant de déficience ferrique souffrent d’une inhibition de la respiration. Dans la plante, la majeure partie du fer se trouve sous forme d’une phosphoprotéine ferrique, la phytoferritine. Celle-ci constitue une réserve de fer dans les feuilles qui permet d’assurer les besoins de la photosynthèse. Les chloroplastes renferment une autre forme de fer, la ferrédoxine. Cette ferroprotéine peut agir comme transporteur d’électron et intervient comme système rédox dans la photosynthèse, dans la réduction des nitrites, des sulfates, dans la fixation de l’azote atmosphérique (dans le cas d’une carence en fer sur soja, on observe une absence ou une raréfaction des nodules).
- Repérer les principaux symptômes foliaires
La déficience en fer est la plus facile à reconnaître. Si la déficience est légère, une pâleur des feuilles peut être confondue avec une faim d’azote. Au stade suivant, apparaît la chlorose internervaire, le jaunissement évolue en une teinte blanc ivoire. Puis les zones décolorées se nécrosent et le bord des feuilles peut aller jusqu’au dessèchement. Dans tous les cas, le fer migrant peu d’une partie de la plante à une autre, sa réutilisation reste localisée et sa carence affecte immédiatement les organes en voie de croissance.
L’assimilation du fer est fortement influencée par des facteurs externes, conditions d’oxydo-réductions, pH, associations cépages - porte-greffes ou variétés – porte-greffes (dans le cas des plantes pérennes)... Aussi, l’analyse des quantités de fer dans la partie végétale prend tout son sens pour s’assurer que l’assimilation en cet élément est à son optimum.
(1) Chlorose : Carence en chlorophylle des plantes se traduisant par la coloration jaune pâle des organes qui devraient être verts (feuilles, tiges) et pouvant avoir des causes diverses (anomalie génétique, carence du sol en fer, infections parasitaires, etc.). Dictionnaire Larousse. (2) Phytosidérophore : bio-molécule présentant une forte affinité pour les métaux, le fer en particulier. Les phytosidérophores sont sécrétés par les Graminées et mobilisent les métaux en formant avec eux des complexes stables et solubles. M.C Girard, C. Walter, J. Berthelin, J.C. Remy, JL Morel. 2005 - Sols et Environnement. Cours et Etudes de cas. Dunod, coll. Sciences Sup. 832 p. (3) Hème : structure aromatique contenant un atome de fer
Bibliographie :
- Oligo-éléments en agriculture, André Loué
- Les bases de la production végétale Tome 1 : Le sol Dominique Soltner
- Le fer dans les sols, P Segalen, ORSTOM